藥品批文“冬眠”與轉(zhuǎn)讓困境 我國(guó)藥品市場(chǎng)結(jié)構(gòu)優(yōu)化的挑戰(zhàn)與機(jī)遇

我國(guó)藥品市場(chǎng)中存在一個(gè)值得關(guān)注的現(xiàn)象:大量藥品批準(zhǔn)文號(hào)長(zhǎng)期處于“冬眠”狀態(tài),即獲批后并未實(shí)際生產(chǎn)或銷售,同時(shí)伴隨頻繁的技術(shù)轉(zhuǎn)讓行為。這一現(xiàn)象背后,折射出我國(guó)藥品產(chǎn)業(yè)結(jié)構(gòu)、監(jiān)管政策與市場(chǎng)機(jī)制的多重問(wèn)題。
一方面,藥品批文“冬眠”與技術(shù)轉(zhuǎn)讓的普遍存在,反映了市場(chǎng)資源配置的失衡。部分企業(yè)為搶占市場(chǎng)先機(jī)或規(guī)避政策風(fēng)險(xiǎn),提前申請(qǐng)批文但缺乏實(shí)際生產(chǎn)能力;另一些企業(yè)則因生產(chǎn)成本高、利潤(rùn)低或市場(chǎng)需求變化,選擇暫停生產(chǎn)。技術(shù)轉(zhuǎn)讓成為企業(yè)盤活閑置資源、調(diào)整產(chǎn)品線的重要途徑,但也可能帶來(lái)質(zhì)量管控風(fēng)險(xiǎn)與市場(chǎng)投機(jī)行為。
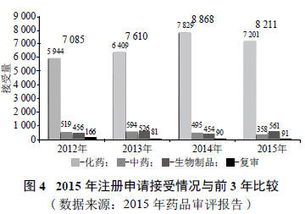
從監(jiān)管角度看,我國(guó)藥品批文管理制度存在優(yōu)化空間。現(xiàn)行法規(guī)對(duì)批文持有者的生產(chǎn)義務(wù)約束有限,導(dǎo)致“僵尸批文”長(zhǎng)期滯留。技術(shù)轉(zhuǎn)讓審批流程復(fù)雜、周期長(zhǎng),部分企業(yè)為規(guī)避監(jiān)管,可能采取不規(guī)范操作,影響藥品質(zhì)量與安全。國(guó)家藥監(jiān)局已通過(guò)仿制藥一致性評(píng)價(jià)、藥品上市許可持有人制度(MAH)等改革,試圖激活存量批文,但落地效果仍需觀察。
市場(chǎng)層面,藥品同質(zhì)化競(jìng)爭(zhēng)加劇了批文閑置現(xiàn)象。我國(guó)藥品批文總量龐大,但創(chuàng)新藥占比低,大量仿制藥批文在帶量采購(gòu)、醫(yī)保控費(fèi)等政策下面臨淘汰。企業(yè)通過(guò)技術(shù)轉(zhuǎn)讓實(shí)現(xiàn)批文流轉(zhuǎn),雖能短期盤活資產(chǎn),但長(zhǎng)期來(lái)看,缺乏核心技術(shù)競(jìng)爭(zhēng)力的產(chǎn)品仍難以持續(xù)。
值得注意的是,批文“冬眠”與技術(shù)轉(zhuǎn)讓的活躍,也預(yù)示著產(chǎn)業(yè)整合的機(jī)遇。隨著MAH制度的推廣,藥品研發(fā)、生產(chǎn)、銷售環(huán)節(jié)逐步專業(yè)化分工,技術(shù)轉(zhuǎn)讓或?qū)⒊蔀閮?yōu)化資源配置的有效工具。若能加強(qiáng)轉(zhuǎn)讓過(guò)程中的質(zhì)量監(jiān)管、明確責(zé)任主體,并鼓勵(lì)創(chuàng)新藥與高價(jià)值仿制藥的批文流轉(zhuǎn),有望推動(dòng)產(chǎn)業(yè)向高質(zhì)量轉(zhuǎn)型。
解決藥品批文閑置問(wèn)題需多方協(xié)同:監(jiān)管部門可探索批文有效期與生產(chǎn)掛鉤的動(dòng)態(tài)管理機(jī)制,簡(jiǎn)化合規(guī)轉(zhuǎn)讓流程;企業(yè)應(yīng)聚焦核心領(lǐng)域,理性申請(qǐng)批文,避免盲目囤積;市場(chǎng)則需通過(guò)競(jìng)爭(zhēng)淘汰低效產(chǎn)能,提升整體供給質(zhì)量。唯有如此,我國(guó)藥品市場(chǎng)才能從“批文存量”時(shí)代邁向“價(jià)值增量”時(shí)代,真正惠及患者與公眾健康。
如若轉(zhuǎn)載,請(qǐng)注明出處:http://www.pkudbdl.com.cn/product/75.html
更新時(shí)間:2026-01-29 07:40:43